Энергетические уровни
Понимание энергетических уровней и переходов между ними — ключ к разгадке многих явлений в квантовой механике и современном мире технологий!

Энергетические уровни — это как лестница, на которой электроны могут стоять, но не могут находиться между ступеньками. Если ты когда-нибудь пытался забраться на крышу, то знаешь, что это не всегда просто. Так вот, электроны тоже имеют свои правила: они прыгают с одной ступеньки на другую, но не могут просто повиснуть в воздухе. Давай разберемся, как это работает!
Что такое энергетические уровни?
Энергетические уровни — это дискретные состояния энергии, которые могут занимать электроны в атомах. Каждое состояние соответствует определенному количеству энергии. Например, в атоме водорода электроны могут находиться на разных уровнях: 1s, 2s, 2p и так далее. Чем выше уровень, тем больше энергии требуется для того, чтобы туда "забраться".
Как электроны "прыгают" между уровнями?
Когда электрон получает достаточно энергии (например, от света или тепла), он может "прыгнуть" на более высокий уровень. Это называется возбуждением. Но если он решит вернуться обратно, он должен выпустить эту энергию в виде света или тепла. Это и есть свечение! Например, когда ты видишь неоновые лампы, это именно такой процесс.
Пример с Python
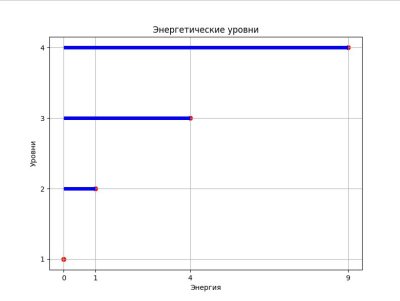
Давай создадим простую модель, которая будет показывать, как электроны могут перемещаться между уровнями. Мы будем использовать библиотеку Matplotlib для визуализации.
import matplotlib.pyplot as plt
#Определяем уровни
levels = [1, 2, 3, 4]
energies = [0, 1, 4, 9] # Энергия пропорциональна квадрату уровня
plt.figure(figsize=(8, 6))
plt.hlines(levels, 0, energies, colors='blue', linewidth=5)
plt.scatter(energies, levels, color='red')
plt.title('Энергетические уровни')
plt.xlabel('Энергия')
plt.ylabel('Уровни')
plt.xticks(energies)
plt.yticks(levels)
plt.grid()
plt.show()
На этом графике видно, как уровни распределены по энергии. Чем выше уровень, тем больше энергии требуется для перехода.
Квантовая механика и энергетические уровни
Теперь давай поговорим о квантовой механике. Она объясняет поведение частиц на очень малых масштабах. В квантовой механике электроны не просто "летают" вокруг ядра; они находятся в облаках вероятности. Это означает, что мы можем только предсказать, где они могут находиться.
Феномен "запрета" на уровне
Интересный факт: электроны не могут занимать одинаковые состояния в одном атоме. Это называется принципом запрета Паули. Представь себе вечеринку: если кто-то уже занял место на диване, ты не сможешь сесть рядом с ним!

Спектры и энергетические уровни
Когда электроны возвращаются на свои уровни после возбуждения, они излучают свет определенной длины волны. Это создает спектр. Каждый элемент имеет свой уникальный спектр. Например, если мы посмотрим на спектр водорода, мы увидим линии в определенных местах — это "подписи" его энергетических уровней.
Пример с анализом спектра
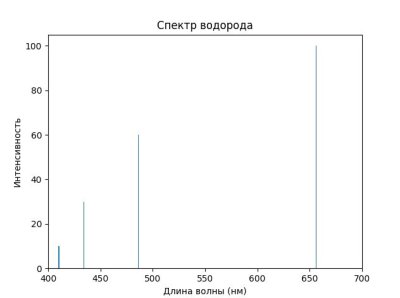
Представь себе, что ты хочешь проанализировать спектр водорода. Мы можем использовать Python для создания простого графика спектра.
import matplotlib.pyplot as plt
import numpy as np
#Длина волн в нанометрах для водорода
wavelengths = np.array([656.3, 486.1, 434.0, 410.2]) # Линии Бальмера
intensities = np.array([100, 60, 30, 10])
plt.bar(wavelengths, intensities)
plt.title('Спектр водорода')
plt.xlabel('Длина волны (нм)')
plt.ylabel('Интенсивность')
plt.xlim(400, 700)
plt.show()
На этом графике видно, как разные длины волн излучаются водородом при переходах между энергетическими уровнями.
Заключение о приложениях
Энергетические уровни имеют множество практических приложений: от лазеров до полупроводников и даже в квантовых компьютерах! Если ты когда-либо задумывался о том, как работает твой смартфон или компьютер, помни: все начинается с этих маленьких энергетических уровней.
Так что в следующий раз, когда увидишь яркий свет или услышишь о новых технологиях — подумай о том, как электроны прыгают по своим уровням и создают всю эту магию!
Задания для закрепления материала
Задача 1: Определение энергетических уровней
В атоме кислорода есть 8 электронов. Определи, сколько энергетических уровней и подуровней могут содержать электроны в этом атоме. Укажи, какие подуровни заполнены.
Задача 2: Переходы между уровнями
Электрон в атоме водорода переходит с уровня n=2 на уровень n=1. Рассчитай, какую длину волны света он излучит при этом переходе, используя формулу Ридберга: 1/λ = R (( 1/n₁² - 1/n₂² )) , где R — постоянная Ридберга (1.097 x 10^7 м^-1).